Achalazja - wytyczne ACG (2013): Różnice pomiędzy wersjami
Nie podano opisu zmian |
|||
| (Nie pokazano 35 wersji utworzonych przez 2 użytkowników) | |||
| Linia 1: | Linia 1: | ||
'''Achalazja''' - | '''Achalazja''' - wytyczne American College of Gastroenterology z sierpnia 2013. | ||
== Definicja i epidemiologia == | |||
Achalazja jest pierwotnym zaburzeniem czynności ruchowej przełyku charakteryzującym się niedostatecznym rozkurczem dolnego zwieracza (''lower esophageal sphincter'', LES) i brakiem perystaltyki przełyku. | |||
Choroba występuje jednakowo często u mężczyzn i u kobiet. Zapadalność wynosi ok. 1 przypadku na 100 000 osób, a chorobowość 10 przypadków/100 000 osób. Szczyt zachorowań przypada między 30. a 60. rokiem życia. | |||
== Diagnostyka i rozpoznanie == | |||
Podstawą rozpoznania achalazji jest wynik badania manometrycznego przełyku, a gastroskopia i badanie radiologiczne są jedynie badaniami uzupełniającymi, gdyż żadne z nich nie ma czułości wystarczającej do samodzielnego potwierdzenia diagnozy: czułość gastroskopii wynosi jedynie ok. 33%, a czułość badania radiologicznego ok. 66%<ref>Howard, Maher, Pryde i in., 1992, s.1015</ref>. | |||
*Achalazję należy podejrzewać u pacjentów z dysfagią podczas połykania pokarmów stałych i płynnych oraz z regurgitacją, nie poddającymi się próbie leczenia właściwą dawką inhibitora pompy protonowej. | |||
*U wszystkich pacjentów z podejrzeniem achalazji, u których podczas gastroskopii lub badania radiologicznego nie stwierdzono mechanicznego upośledzenia drożności, przed postawieniem rozpoznania achalazji '''powinno''' się wykonać manometrię przełyku. | |||
*Wykonanie badania z barytem w celu oceny opróżniania przełyku oraz morfologii połączenia przełykowo-żołądkowego (''gastro-esophageal junction'', GEJ) zalecane jest u pacjentów z niejednoznacznym wynikiem badania manometrycznego przełyku | |||
*U wszystkich pacjentów z achalazją zalecana jest endoskopowa ocena połączenia przełykowo-żołądkowego i wpustu dla wykluczenia pseudoachalazji<ref>Przyczyny pseudoachalazji: | |||
*guzy wpustu | |||
*naciek nowotworowy przywspółczulnego splotu Auerbacha (rak wpustu, trzustki, piersi, płuca, wątrobowokomórkowy) | |||
Przyczyny achalazji wtórnej: | |||
*przebyta fundooplikacja | |||
*przebyte założenie opaski na żołądek | |||
*[[choroba Chagasa]]</ref>. | |||
=== Manometria przełyku === | |||
W diagnostyce achalazji zastosowanie ma zarówno manometria standardowa jak i manometria wysokiej rozdzielczości (''high resolution manometry'', HRM). HRM umożliwia łatwiejsze i bardziej powtarzalne określenie podtypu achalazji. | |||
Wynik manometrii w achalazji: | |||
*brak perystaltyki przełyku | |||
**całkowity brak skurczów perystaltycznych (podtyp I) | |||
**jednoczesne wielopoziomowe skurcze o amplitudzie < 40 mmHg (podtyp II) | |||
**jednoczesne wielopoziomowe skurcze lub fala perystyltyczna o amplitudzie > 40 mmHg (podtyp III, ''krzepka achalazja'') | |||
*Niepełny rozkurcz LES (ze zwiększonym spoczynkowym napięciem zwieracza lub bez) | |||
=== Badanie radiologiczne === | |||
Rolą badania radiologicznego jest potwierdzenie rozpoznania w przypadkach, gdy wynik manometrii jest niejednoznaczny. Za rozpoznaniem achalazji przemawia wykazanie: | |||
*poszerzenia przełyku | |||
*zwężenia GEJ z obrazem "ptasiego dzioba" | |||
*braku perystaltyki przełyku | |||
*spowolnionego opróżniania przełyku z barytu | |||
Oprócz diagnostyki, badanie radiologiczne z kontrastem przydatne jest przy wyborze metody leczenia uwidaczniając ewentualny kręty przebieg i zagięcia przełyku oraz jego znaczne poszerzenie. Z kolei wykonanie badania radiologicznego z kontrastem po leczeniu pozwala na ocenę skuteczności terapii (ocena opróżniania przełyku, ''timed barium esophagram'', TBE). | |||
=== Endoskopia === | |||
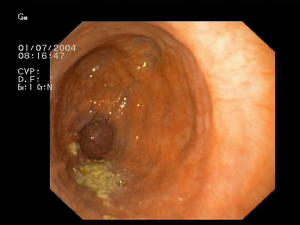
[[Plik:Achalazja_01.png|thumb|right|Typowy obraz endoskopowy: znaczne poszerzenie światła, zamknięty wpust, zaleganie treści pokarmowej i uchyłki.]] | |||
Podstawową rolą badania endoskopowego w diagnostyce achalazji jest wykluczenie zwężenia mechanicznego oraz pseudoachalazji. Typowe dla achalazji objawy w postaci poszerzenia przełyku z zaleganiem w nim pokarmu śliny oraz zaciśnięcia GEJ cechują się niską czułością. | |||
W przypadku stwierdzenia '''typowych''' objawów achalazji nie ma potrzeby pobierania wycinków. Jeśli zostaną one pobrane w przypadkach wątpliwych, ich badanie może wykazać naciek eozynofili bardzo trudny do odróżnienia od analogicznego nacieku w przebiegu zapalenia eozynofilowego, będącego również przyczyną dysfagii. W takiej sytuacji badaniem różnicującym jest manometria. | |||
Jeśli przejście przez GEJ wiąże się z wyczuwaniem silnego oporu należy podejrzewać pseudoachalazję (w achalazji oporu się nie wyczuwa lub jest on niewielki). W sytuacji takiej zalecane jest wykonanie EUS. | |||
=== Endosonografia === | |||
Rolą EUS jest wykluczenie pseudoachalazji (poprzez wykazanie braku naciekającego guza) oraz potwierdzenie rozpoznania w budzących wątpliwości przypadkach ''krzepkiej achalazji'' (wykazanie pogrubienia okrężnej warstwy mięśniówki LES oraz mięśniówki gładkiej przełyku). Badanie to powinno być wykonane u pacjentów z objawami sugerującymi chorobę nowotworową: | |||
*w starszym wieku, z krótkimi wywiadami dysfagii i jednocześnie dużą utratą ciężaru ciała | |||
*z wyczuwalnym dużym oporem przy przechodzeniu GEJ podczas gastroskopii | |||
== Leczenie == | |||
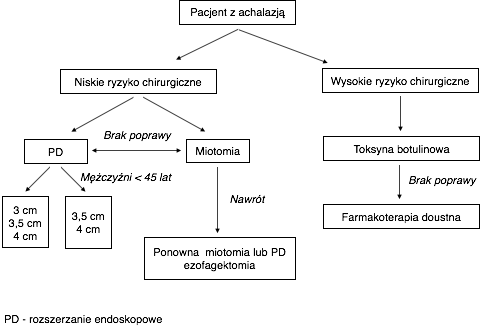
[[Plik:Schemat achalazja.png|600px]] | |||
[[Media:Schemat achalazja.pdf|Pobierz jako PDF]] | |||
*U pacjentów kwalifikujących się do leczenia zabiegowego zalecanymi metodami początkowego leczenia są stopniowane poszerzanie balonem pneumatycznym (''pneumatic dilation'', PD) albo chirugiczna miotomia laparoskopowa z częściową fundoplikacją. | |||
*Obydwa te zabiegi powinny być dokonywane w doświadczonych ośrodkach z dużą liczbą wykonywanych procedur | |||
*Przy wyborze metody początkowego leczenia należy kierować się takimi czynnikami, jak wiek pacjenta, jego płeć, preferencje oraz doświadczenie ośrodka wykonującego zabieg. | |||
*Leczenie wstrzyknięciami toksyny botulinowej powinno być stosowane u pacjentów nie kwalifikujących się do leczenia zabiegowego | |||
*Leczenie farmakologiczne może być stosowane jedynie u pacjentów którzy nie chcą bądź nie mogą być leczeni zabiegowo i u których nieskuteczne okazały się wstrzyknięcia toksyny botulinowej. | |||
=== Cele leczenia === | |||
Leczenie ukierunkowane jest na zmniejszenie napięcia LES, co ma doprowadzić do zmniejszenia dolegliwości pacjenta, poprawy opróżniania przełyku i zapobieżenia jego dalszemu poszerzaniu się. Nie istnieją metody poprawiające perystaltykę przełyku. Z biegiem czasu napięcie LES rośnie, co wymaga powtarzania interwencji leczniczych. | |||
=== Leczenie farmakologiczne === | |||
==== Leki podawane doustnie ==== | |||
Jest to najmniej skuteczna metoda leczenia achalazji. Stosowane są<ref>Wytyczne wspominają jeszcze o sildenafilu, β-mimetykach, teofilinie i lekach antycholinergicznych, ale ogólnikowo i bez podania dawkowania</ref>: | |||
*leki blokujące kanały wapnia (nifedipina 10-30 mg s.l. 30-45 min przed posiłkiem) | |||
*nitraty (np. diazotan izosorbidu 5 mg s.l. 10-15 minut przed posiłkiem) | |||
==== Leki podawane przez endoskop ==== | |||
Toksyna botulinowa hamuje uwalnianie acetylocholiny z zakończeń nerwowych powodując zwiotczenie mięśniówki. Leczenie to eliminuje jedynie komponentę neurogenną skurczu nie wpływając na komponentę miogenną, dlatego spoczynkowe napięcie LES obniża się po wstrzyknięciu botuliny tylko o około 50%. | |||
Dawkowanie: | |||
*po 100 j. w każdy kwadrant wstrzykiwane tuż nad łączem żołądkowo-przełykowym (rozpuszcza się w soli fizjologicznej by uzyskać stężenie 100 j./1 ml i wstrzykuje po 0,5-1 ml); zwiększanie dawki nie poprawia efektu. | |||
Leczenie jest skuteczne u 75% chorych. Około 50% pacjentów wymaga ponownego wstrzyknięcia w ciągu 6-24 miesięcy. Leczenie za pomocą toksyny botulinowej utrudnia późniejsze wykonanie chirurgicznej miotomii. | |||
=== Rozszerzanie endoskopowe === | |||
*Pacjent kwalifikowany do endoskopowego leczenia achalazji musi jednocześnie kwalifikować się do leczenia operacyjnego ze względu na stosunkowo duże ryzyko wystąpienia powikłań wymagających interwencji chirurgicznej<ref>Ryzyko perforacji przełyku wynosi 1,9%. Do perforacji dochodzi najczęściej podczas pierwszego zabiegu.</ref>. Z tego też powodu ośrodek wykonujący zabiegi endoskopowe musi dysponować odpowiednim zapleczem chirurgicznym. | |||
*Choć tradycyjnie podczas zabiegu korzysta się z fluoroskopii, istnieją dane sugerujące, iż nie jest ona konieczna<ref>Rai, Shende, Joshi i in. 2005, s. 427-431.</ref> | |||
*Zabieg wykonywany jest w znieczuleniu dożylnym z użyciem balonów pneumatycznych o różnych średnicach (30 mm, 35 mm, 40 mm). Pierwszy zabieg wykonuje się balonem 30 mm (u mężczyzn przed 45 r.ż. - 35 mm). Balony nadmuchuje się do ciśnienia 0,5-1 atm na 15-60 sekund. | |||
*Po zabiegu u każdego pacjenta należy wykonać badanie z kontrastem płynnym, a następnie z barytem dla upewnienia się, ze nie doszło do perforacji. | |||
*Zabieg może być wykonywany w trybie ambulatoryjnym, a po wykonaniu kontrolnego badania radiologicznego można wypisać pacjenta do domu z zaleceniem niezwłocznego wezwania pomocy w przypadku wystąpienia silnego bólu w klatce piersiowej z lub bez gorączki. | |||
*Po 4-6 tygodniach ocenia się skuteczność zabiegu biorąc pod uwagę objawy i wynik badania radiologicznego. W razie braku poprawy powtarza się zabieg balonem o kolejnej, większej średnicy. | |||
*U 70% pacjentów po roku utrzymuje się poprawa. U 1/3 pacjentów objawy nawracają w ciągu 4-6 lat. | |||
=== Leczenie chirurgiczne === | |||
==== Miotomia chirurgiczna ==== | |||
*Preferowane są zabiegi laparoskopowe m. Hellera z uwagi na mniejszą (od torakotomii) liczbę powikłań i szybszy powrót pacjenta do zdrowia. | |||
*W celu zmniejszenia ryzyko wystąpienia po zabiegu choroby refluksowej miotomia powinna być uzupełniona o zabieg fundoplikacji. | |||
*Według '''niektórych''' badań wcześniejszy zabieg rozszerzania endoskopowego zwiększa ryzyko wystąpienia śródoperacyjnej perforacji błony śluzowej. | |||
==== Ezofagektomia ==== | |||
*Zabieg ezofagektomii wykonuje się u pacjentów ze znacznym poszerzeniem i krętym przebiegiem przełyku, u których nieskuteczne okazał się zabieg endoskopowy lub chirurgiczna miotomia, i których stan pozwala na wykonie zabiegu operacyjnego. | |||
*U większości pacjentów zabiegiem pierwszego wyboru jest ezofagektomia z interpozycją żołądka, choć brak jest badań porównawczych z ezofagektomią z interpozycją jelita grubego. | |||
*Zabieg przynosi poprawę u 80% pacjentów; u 50% z nich występuje dysfagia wymagająca rozszerzania endoskopowego; śmiertelność zabiegu wynosi 0-5,4%. | |||
== Nadzór nad pacjentem po leczeniu == | |||
Celem prowadzenia nadzoru po leczeniu jest możliwie wczesne rozpoznanie nawrotu choroby by zapobiec znacznemu poszerzeniu przełyku (''megaesophagus, end-stage achalasia'')<ref>Brak jest jednoznacznych kryteriów określających ten stan. Za znaczne poszerzenie przełyku przyjmuje się m. in. jego szerokość > 6 cm, esowaty przebieg i ostre zagięcie w odcinku dystalnym. Sytuacja taka pociąga za sobą nieskuteczność ewentualnego zabiegu miotomii ze względu na utrudnienie pasażu treści przez przełyk.</ref> oraz wzrostowi ryzyka zachorowania na raka płaskonabłonkowego. | |||
*Ustąpieniu dolegliwości '''nie''' musi towarzyszyć poprawa opróżniania przełyku, dlatego opieranie się jedynie na wywiadach w ocenie skuteczności zabiegu jest niewystarczające. | |||
*Stwierdzenie w badaniu TBE nieprawidłowej wysokości kolumny barytu w przełyku w 5 minut po jego podaniu koreluje silnie z nawrotem objawowej achalazji w ciągu roku. Dlatego badanie to powinno służyć ocenie skuteczności leczenia, a rozsądne jest jego dalsze powtarzanie w odstępach rocznych. | |||
*Nawrót objawowej choroby pozwala też przewidzieć stwierdzenie w manometrii napięcia spoczynkowego LES > 10 mmHg. | |||
*Wybór pomiędzy manometrią a TBE zależny jest od możliwości i doświadczenia danego ośrodka, tolerancji konkretnego badania przez pacjenta i jego wrażliwości na promieniowanie rentgenowskie. | |||
*Brak jest wytycznych, jak często należy wykonywać badania w ramach nadzoru po zabiegu. Brak też danych uzasadniających wdrażanie leczenia u '''bezobjawowych''' pacjentów, u których TBE bądź manometria wykazały duże ryzyko nawrotu objawowej choroby w ciągu roku. | |||
*Brak jest wystarczających danych uzasadniających rutynowe zalecanie pacjentom z achalazją nadzoru onkologicznego w kierunku raka przełyku<ref>Ryzyko raka płaskonabłonkowego przełyku jest u tych chorych zwiększone ok. 28 razy w stosunku do populacji ogólnej</ref>. Jednak niektórzy eksperci zalecają pacjentom z chorobą trwającą ponad 10-15 lat wykonywanie gastroskopii co 3 lata. | |||
== Przypisy == | |||
<references /> | |||
== Bibliografia == | == Bibliografia == | ||
*Michael F. | *Howard P.J. , Maher L. , Pryde A., Cameron E.W.J., Heading R.C. [http://gut.bmj.com/content/33/8/1011.long ''Five year prospective study of the incidence, clinical features, and diagnosis of achalasia in Edinburgh.''] "Gut". 1992, 33, str. 1011 – 5. | ||
*Rai Ramesh R., Shende Atul, Joshi Ashish, Mathur Amit, Nijhawan Sandeep. ''Rigiflex pneumatic dilation of achalasia without fluoroscopy: a novel office procedure.'' "Gastrointestinal Endoscopy". 2005, 62(3), s. 427-431 | |||
*Vaezi Michael F., Pandolfino John E., Vela Marcelo F. [http://gi.org/wp-content/uploads/2013/07/ACG_Guideline_Achalasia_July_2013.pdf ACG ''Clinical Guideline: Diagnosis and Management of Achalasia.''] "American Journal of Gastroenterology". 2013-08, 108(8), str. 1238-1249. doi: 10.1038/ajg.2013.196 | |||
[[Kategoria:Choroby]] | [[Kategoria:Choroby]] | ||
| Linia 10: | Linia 122: | ||
[[Kategoria:Standardy, wytyczne i zasady postępowania]] | [[Kategoria:Standardy, wytyczne i zasady postępowania]] | ||
[[Kategoria:American College of Gastroenterology]] | [[Kategoria:American College of Gastroenterology]] | ||
[[Kategoria:Wszystkie artykuły]] | |||
Aktualna wersja na dzień 17:24, 1 sie 2015
Achalazja - wytyczne American College of Gastroenterology z sierpnia 2013.
Definicja i epidemiologia
Achalazja jest pierwotnym zaburzeniem czynności ruchowej przełyku charakteryzującym się niedostatecznym rozkurczem dolnego zwieracza (lower esophageal sphincter, LES) i brakiem perystaltyki przełyku.
Choroba występuje jednakowo często u mężczyzn i u kobiet. Zapadalność wynosi ok. 1 przypadku na 100 000 osób, a chorobowość 10 przypadków/100 000 osób. Szczyt zachorowań przypada między 30. a 60. rokiem życia.
Diagnostyka i rozpoznanie
Podstawą rozpoznania achalazji jest wynik badania manometrycznego przełyku, a gastroskopia i badanie radiologiczne są jedynie badaniami uzupełniającymi, gdyż żadne z nich nie ma czułości wystarczającej do samodzielnego potwierdzenia diagnozy: czułość gastroskopii wynosi jedynie ok. 33%, a czułość badania radiologicznego ok. 66%[1].
- Achalazję należy podejrzewać u pacjentów z dysfagią podczas połykania pokarmów stałych i płynnych oraz z regurgitacją, nie poddającymi się próbie leczenia właściwą dawką inhibitora pompy protonowej.
- U wszystkich pacjentów z podejrzeniem achalazji, u których podczas gastroskopii lub badania radiologicznego nie stwierdzono mechanicznego upośledzenia drożności, przed postawieniem rozpoznania achalazji powinno się wykonać manometrię przełyku.
- Wykonanie badania z barytem w celu oceny opróżniania przełyku oraz morfologii połączenia przełykowo-żołądkowego (gastro-esophageal junction, GEJ) zalecane jest u pacjentów z niejednoznacznym wynikiem badania manometrycznego przełyku
- U wszystkich pacjentów z achalazją zalecana jest endoskopowa ocena połączenia przełykowo-żołądkowego i wpustu dla wykluczenia pseudoachalazji[2].
Manometria przełyku
W diagnostyce achalazji zastosowanie ma zarówno manometria standardowa jak i manometria wysokiej rozdzielczości (high resolution manometry, HRM). HRM umożliwia łatwiejsze i bardziej powtarzalne określenie podtypu achalazji.
Wynik manometrii w achalazji:
- brak perystaltyki przełyku
- całkowity brak skurczów perystaltycznych (podtyp I)
- jednoczesne wielopoziomowe skurcze o amplitudzie < 40 mmHg (podtyp II)
- jednoczesne wielopoziomowe skurcze lub fala perystyltyczna o amplitudzie > 40 mmHg (podtyp III, krzepka achalazja)
- Niepełny rozkurcz LES (ze zwiększonym spoczynkowym napięciem zwieracza lub bez)
Badanie radiologiczne
Rolą badania radiologicznego jest potwierdzenie rozpoznania w przypadkach, gdy wynik manometrii jest niejednoznaczny. Za rozpoznaniem achalazji przemawia wykazanie:
- poszerzenia przełyku
- zwężenia GEJ z obrazem "ptasiego dzioba"
- braku perystaltyki przełyku
- spowolnionego opróżniania przełyku z barytu
Oprócz diagnostyki, badanie radiologiczne z kontrastem przydatne jest przy wyborze metody leczenia uwidaczniając ewentualny kręty przebieg i zagięcia przełyku oraz jego znaczne poszerzenie. Z kolei wykonanie badania radiologicznego z kontrastem po leczeniu pozwala na ocenę skuteczności terapii (ocena opróżniania przełyku, timed barium esophagram, TBE).
Endoskopia
Podstawową rolą badania endoskopowego w diagnostyce achalazji jest wykluczenie zwężenia mechanicznego oraz pseudoachalazji. Typowe dla achalazji objawy w postaci poszerzenia przełyku z zaleganiem w nim pokarmu śliny oraz zaciśnięcia GEJ cechują się niską czułością.
W przypadku stwierdzenia typowych objawów achalazji nie ma potrzeby pobierania wycinków. Jeśli zostaną one pobrane w przypadkach wątpliwych, ich badanie może wykazać naciek eozynofili bardzo trudny do odróżnienia od analogicznego nacieku w przebiegu zapalenia eozynofilowego, będącego również przyczyną dysfagii. W takiej sytuacji badaniem różnicującym jest manometria.
Jeśli przejście przez GEJ wiąże się z wyczuwaniem silnego oporu należy podejrzewać pseudoachalazję (w achalazji oporu się nie wyczuwa lub jest on niewielki). W sytuacji takiej zalecane jest wykonanie EUS.
Endosonografia
Rolą EUS jest wykluczenie pseudoachalazji (poprzez wykazanie braku naciekającego guza) oraz potwierdzenie rozpoznania w budzących wątpliwości przypadkach krzepkiej achalazji (wykazanie pogrubienia okrężnej warstwy mięśniówki LES oraz mięśniówki gładkiej przełyku). Badanie to powinno być wykonane u pacjentów z objawami sugerującymi chorobę nowotworową:
- w starszym wieku, z krótkimi wywiadami dysfagii i jednocześnie dużą utratą ciężaru ciała
- z wyczuwalnym dużym oporem przy przechodzeniu GEJ podczas gastroskopii
Leczenie
- U pacjentów kwalifikujących się do leczenia zabiegowego zalecanymi metodami początkowego leczenia są stopniowane poszerzanie balonem pneumatycznym (pneumatic dilation, PD) albo chirugiczna miotomia laparoskopowa z częściową fundoplikacją.
- Obydwa te zabiegi powinny być dokonywane w doświadczonych ośrodkach z dużą liczbą wykonywanych procedur
- Przy wyborze metody początkowego leczenia należy kierować się takimi czynnikami, jak wiek pacjenta, jego płeć, preferencje oraz doświadczenie ośrodka wykonującego zabieg.
- Leczenie wstrzyknięciami toksyny botulinowej powinno być stosowane u pacjentów nie kwalifikujących się do leczenia zabiegowego
- Leczenie farmakologiczne może być stosowane jedynie u pacjentów którzy nie chcą bądź nie mogą być leczeni zabiegowo i u których nieskuteczne okazały się wstrzyknięcia toksyny botulinowej.
Cele leczenia
Leczenie ukierunkowane jest na zmniejszenie napięcia LES, co ma doprowadzić do zmniejszenia dolegliwości pacjenta, poprawy opróżniania przełyku i zapobieżenia jego dalszemu poszerzaniu się. Nie istnieją metody poprawiające perystaltykę przełyku. Z biegiem czasu napięcie LES rośnie, co wymaga powtarzania interwencji leczniczych.
Leczenie farmakologiczne
Leki podawane doustnie
Jest to najmniej skuteczna metoda leczenia achalazji. Stosowane są[3]:
- leki blokujące kanały wapnia (nifedipina 10-30 mg s.l. 30-45 min przed posiłkiem)
- nitraty (np. diazotan izosorbidu 5 mg s.l. 10-15 minut przed posiłkiem)
Leki podawane przez endoskop
Toksyna botulinowa hamuje uwalnianie acetylocholiny z zakończeń nerwowych powodując zwiotczenie mięśniówki. Leczenie to eliminuje jedynie komponentę neurogenną skurczu nie wpływając na komponentę miogenną, dlatego spoczynkowe napięcie LES obniża się po wstrzyknięciu botuliny tylko o około 50%.
Dawkowanie:
- po 100 j. w każdy kwadrant wstrzykiwane tuż nad łączem żołądkowo-przełykowym (rozpuszcza się w soli fizjologicznej by uzyskać stężenie 100 j./1 ml i wstrzykuje po 0,5-1 ml); zwiększanie dawki nie poprawia efektu.
Leczenie jest skuteczne u 75% chorych. Około 50% pacjentów wymaga ponownego wstrzyknięcia w ciągu 6-24 miesięcy. Leczenie za pomocą toksyny botulinowej utrudnia późniejsze wykonanie chirurgicznej miotomii.
Rozszerzanie endoskopowe
- Pacjent kwalifikowany do endoskopowego leczenia achalazji musi jednocześnie kwalifikować się do leczenia operacyjnego ze względu na stosunkowo duże ryzyko wystąpienia powikłań wymagających interwencji chirurgicznej[4]. Z tego też powodu ośrodek wykonujący zabiegi endoskopowe musi dysponować odpowiednim zapleczem chirurgicznym.
- Choć tradycyjnie podczas zabiegu korzysta się z fluoroskopii, istnieją dane sugerujące, iż nie jest ona konieczna[5]
- Zabieg wykonywany jest w znieczuleniu dożylnym z użyciem balonów pneumatycznych o różnych średnicach (30 mm, 35 mm, 40 mm). Pierwszy zabieg wykonuje się balonem 30 mm (u mężczyzn przed 45 r.ż. - 35 mm). Balony nadmuchuje się do ciśnienia 0,5-1 atm na 15-60 sekund.
- Po zabiegu u każdego pacjenta należy wykonać badanie z kontrastem płynnym, a następnie z barytem dla upewnienia się, ze nie doszło do perforacji.
- Zabieg może być wykonywany w trybie ambulatoryjnym, a po wykonaniu kontrolnego badania radiologicznego można wypisać pacjenta do domu z zaleceniem niezwłocznego wezwania pomocy w przypadku wystąpienia silnego bólu w klatce piersiowej z lub bez gorączki.
- Po 4-6 tygodniach ocenia się skuteczność zabiegu biorąc pod uwagę objawy i wynik badania radiologicznego. W razie braku poprawy powtarza się zabieg balonem o kolejnej, większej średnicy.
- U 70% pacjentów po roku utrzymuje się poprawa. U 1/3 pacjentów objawy nawracają w ciągu 4-6 lat.
Leczenie chirurgiczne
Miotomia chirurgiczna
- Preferowane są zabiegi laparoskopowe m. Hellera z uwagi na mniejszą (od torakotomii) liczbę powikłań i szybszy powrót pacjenta do zdrowia.
- W celu zmniejszenia ryzyko wystąpienia po zabiegu choroby refluksowej miotomia powinna być uzupełniona o zabieg fundoplikacji.
- Według niektórych badań wcześniejszy zabieg rozszerzania endoskopowego zwiększa ryzyko wystąpienia śródoperacyjnej perforacji błony śluzowej.
Ezofagektomia
- Zabieg ezofagektomii wykonuje się u pacjentów ze znacznym poszerzeniem i krętym przebiegiem przełyku, u których nieskuteczne okazał się zabieg endoskopowy lub chirurgiczna miotomia, i których stan pozwala na wykonie zabiegu operacyjnego.
- U większości pacjentów zabiegiem pierwszego wyboru jest ezofagektomia z interpozycją żołądka, choć brak jest badań porównawczych z ezofagektomią z interpozycją jelita grubego.
- Zabieg przynosi poprawę u 80% pacjentów; u 50% z nich występuje dysfagia wymagająca rozszerzania endoskopowego; śmiertelność zabiegu wynosi 0-5,4%.
Nadzór nad pacjentem po leczeniu
Celem prowadzenia nadzoru po leczeniu jest możliwie wczesne rozpoznanie nawrotu choroby by zapobiec znacznemu poszerzeniu przełyku (megaesophagus, end-stage achalasia)[6] oraz wzrostowi ryzyka zachorowania na raka płaskonabłonkowego.
- Ustąpieniu dolegliwości nie musi towarzyszyć poprawa opróżniania przełyku, dlatego opieranie się jedynie na wywiadach w ocenie skuteczności zabiegu jest niewystarczające.
- Stwierdzenie w badaniu TBE nieprawidłowej wysokości kolumny barytu w przełyku w 5 minut po jego podaniu koreluje silnie z nawrotem objawowej achalazji w ciągu roku. Dlatego badanie to powinno służyć ocenie skuteczności leczenia, a rozsądne jest jego dalsze powtarzanie w odstępach rocznych.
- Nawrót objawowej choroby pozwala też przewidzieć stwierdzenie w manometrii napięcia spoczynkowego LES > 10 mmHg.
- Wybór pomiędzy manometrią a TBE zależny jest od możliwości i doświadczenia danego ośrodka, tolerancji konkretnego badania przez pacjenta i jego wrażliwości na promieniowanie rentgenowskie.
- Brak jest wytycznych, jak często należy wykonywać badania w ramach nadzoru po zabiegu. Brak też danych uzasadniających wdrażanie leczenia u bezobjawowych pacjentów, u których TBE bądź manometria wykazały duże ryzyko nawrotu objawowej choroby w ciągu roku.
- Brak jest wystarczających danych uzasadniających rutynowe zalecanie pacjentom z achalazją nadzoru onkologicznego w kierunku raka przełyku[7]. Jednak niektórzy eksperci zalecają pacjentom z chorobą trwającą ponad 10-15 lat wykonywanie gastroskopii co 3 lata.
Przypisy
- ↑ Howard, Maher, Pryde i in., 1992, s.1015
- ↑ Przyczyny pseudoachalazji:
- guzy wpustu
- naciek nowotworowy przywspółczulnego splotu Auerbacha (rak wpustu, trzustki, piersi, płuca, wątrobowokomórkowy)
- przebyta fundooplikacja
- przebyte założenie opaski na żołądek
- choroba Chagasa
- ↑ Wytyczne wspominają jeszcze o sildenafilu, β-mimetykach, teofilinie i lekach antycholinergicznych, ale ogólnikowo i bez podania dawkowania
- ↑ Ryzyko perforacji przełyku wynosi 1,9%. Do perforacji dochodzi najczęściej podczas pierwszego zabiegu.
- ↑ Rai, Shende, Joshi i in. 2005, s. 427-431.
- ↑ Brak jest jednoznacznych kryteriów określających ten stan. Za znaczne poszerzenie przełyku przyjmuje się m. in. jego szerokość > 6 cm, esowaty przebieg i ostre zagięcie w odcinku dystalnym. Sytuacja taka pociąga za sobą nieskuteczność ewentualnego zabiegu miotomii ze względu na utrudnienie pasażu treści przez przełyk.
- ↑ Ryzyko raka płaskonabłonkowego przełyku jest u tych chorych zwiększone ok. 28 razy w stosunku do populacji ogólnej
Bibliografia
- Howard P.J. , Maher L. , Pryde A., Cameron E.W.J., Heading R.C. Five year prospective study of the incidence, clinical features, and diagnosis of achalasia in Edinburgh. "Gut". 1992, 33, str. 1011 – 5.
- Rai Ramesh R., Shende Atul, Joshi Ashish, Mathur Amit, Nijhawan Sandeep. Rigiflex pneumatic dilation of achalasia without fluoroscopy: a novel office procedure. "Gastrointestinal Endoscopy". 2005, 62(3), s. 427-431
- Vaezi Michael F., Pandolfino John E., Vela Marcelo F. ACG Clinical Guideline: Diagnosis and Management of Achalasia. "American Journal of Gastroenterology". 2013-08, 108(8), str. 1238-1249. doi: 10.1038/ajg.2013.196