Przełyk Barretta - wytyczne BGS (2013): Różnice pomiędzy wersjami
m (Gpool przeniósł stronę Przełyk Barretta na Przełyk Barretta - wytyczne BGS (2013), bez pozostawienia przekierowania pod starym tytułem) |
Nie podano opisu zmian |
||
| (Nie pokazano 11 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
'''Diagnostyka i postępowanie w przełyku Barretta''' - wytyczne British Society of Gastroenterology (2013) | |||
[[Plik:Schemat Barr.png|550px]] | |||
[[Media:Schemat Barr.pdf|Pobierz jako PDF]] | |||
== Rozpoznanie == | |||
*Przełykiem Barretta określą się stan, w którym jakakolwiek część prawidłowego płaskiego nabłonka dalszej części przełyku zostaje zastąpiona przez metaplastyczny nabłonek walcowaty<ref>W wytycznych brytyjskich do rozpoznania przełyku Barretta wystarczy stwierdzenie jakiejkowiek metaplazji, a nie tylko metaplazji jelitowej (MJ). Wynika to z faktu, że niektóre badania wykazywały, iż częstość raka u osób bez metaplazji jelitowej i z MJ jest bardzo podobna. Oprócz tego, w długich (>3 cm) segmentach Barretta metaplazja jest prawie zawsze obecna, a jej brak w badaniu histopatologicznym wynika z nietrafionego pobrania wycinków. Jednak obecność MJ powinna być brana pod uwagę przy podejmowaniu decyzji o prowadzeniu nadzoru u pacjenta.</ref> dobrze widoczny w badaniu endoskopowym (≥ 1 cm) ponad łączem przełykowo-żołądkowym (Gastro-Oesophageal Junction, GOJ)<ref>Za granicę przełyku i żołądka (GOJ) najłatwiej przyjąć bliższe zakończenia podłużnych fałdów trzonu żołądka przy minimalnej insuflacji. Można też za nią uznać poziom dystalnych zakończeń naczyń palisadowych, ale to kryterium cechuje się znacznie mniejszą powtarzalnością. Obecność wypustek nabłonka walcowatego sięgających mniej niż 1 cm ponad GOJ określa się, jako nieregularną linię Z, a '''nie''' jako przełyk Barretta. Do 40% przypadków nieregularnej linii Z może wiązać się z obecnością metaplazji jelitowej, ale znacznie kliniczne tego faktu nie jest jasne. Rutynowe wykonywanie biopsji w przypadku nieregularnej linii Z '''nie''' jest konieczne - wykonuje się ją tylko w razie wątpliwości diagnostycznych.</ref> i potwierdzony badaniem histopatologicznym pobranych podczas gastroskopii wycinków<ref>Minimalna liczba wycinków, jakie powinny zostać pobrane przy podejrzeniu przełyku Barretta, to '''8''' (także w przypadku krótkiego segmentu).</ref>. | |||
*Opis badania endoskopowego powinien zawierać '''co najmniej''': | |||
**długość segmentu Barretta (według kryteriów praskich: C - zasięg zmian zajmujących cały obwód, M - maksymalny zasięg zmian wyrażony w centymetrach) | |||
**opis wszystkich wysp nabłonka walcowatego dostrzeżonych ponad górną granicą zasięgu zmian ciągłych | |||
== Badania przesiewowe w kierunku przełyku Barretta == | |||
*Prowadzenie w populacji ogólnej badań przesiewowych w kierunku przełyku Barretta z wykorzystaniem gastroskopii nie jest możliwe ani uzasadnione. | |||
*Prowadzenie takich badań może zostać rozważone w przypadku pacjentów z przewlekłymi objawami choroby refluksowej przełyku (gastro-oesophageal reflux disease, GERD) i z co najmniej trzema czynnikami ryzyka tego stanu<ref>Czynniki te to: | |||
*wiek ≥ 50 | |||
*rasa biała | |||
*płeć męska | |||
z | *otyłość | ||
Inne czynniki ryzyka przełyku Barretta: | |||
*obecność objawów choroby refuksowej | |||
*wywiady rodzinne przełyku Barretta bądź gruczolakoraka przełyku | |||
*palenie tytoniu (tylko w niektórych badaniach)</ref>. Warunek obecności trzech czynników ryzyka nie obowiązuje w przypadku osób z wywiadami rodzinnymi przełyku Barretta lub gruczolakoraka przełyku u krewnego I stopnia. | |||
== Nadzór onkologiczny pacjentów z przełykiem Barretta == | |||
* Pomimo braku dostatecznej ilości danych z badań randomizowanych, wskazujących na to, że prowadzenie nadzoru koreluje z niższym zaawansowaniem wykrywanych zmian i poprawą przeżywalnością, nadzór onkologiczny jest w zasadzie zalecany. | |||
*Jedyną dostępną obecnie metodą nadzoru, mającą wystarczające oparcie w wynikach badań, jest powtarzanie gastroskopii z poszukiwaniem dysplazji w badaniu histopatologicznym pobranych wycinków | |||
**badania w ramach nadzoru powinny być wykonywane endoskopami o wysokiej rozdzielczości | |||
**brak wystarczającej ilości danych, by zalecać wykonywanie w ramach nadzoru gastroskopii przeznosowej w miejsce klasycznej | |||
**zaawansowane techniki obrazowania, takie jak chromoendoskopia czy "wirtualna chromoendoskopia" nie mają w nadzorze przełyku Barretta przewagi nad gastroskopią z użyciem światła białego i nie powinny być dlatego zalecane do rutynowego stosowania | |||
**nadzór onkologiczny '''nie''' jest generalnie zalecany u pacjentów z MJ wpustu oraz z nieregularnym przebiegiem linii Z, niezależnie od tego czy stwierdzono u nich MJ czy nie | |||
**wycinki powinny być pobierane z 4 kwadrantów co 2 cm oraz ze wszystkich widocznych zmian | |||
*Programy nadzoru onkologicznego powinny brać pod uwagę '''obecność MJ''' oraz '''długość segmentu Barretta'''<ref>O tym czy w przypadku konkretnego pacjenta należy wdrożyć nadzór decydować powinno prawdopodobieństwo rozwoju u niego raka, jego zdolność do poddania się powtarzanym badaniom, a także jego preferencje.</ref> | |||
**Pacjenci z segmentem Barretta < 3 cm, u których badanie histopatologiczne nie wykazało MJ ani dysplazji - zalecana jest powtórna gastroskopia z biopsją kwadrantową dla potwierdzenia rozpoznania po 3-5 latach (czas ten może być krótszy, jeśli rozpoznanie jest mało wiarygodne). Jeśli ponowne badanie potwierdzi brak MJ zaleca się wyłączenie pacjenta z nadzoru, gdyż ryzyko związane z badaniem przewyższa prawdopodobnie wynikające z niego korzyści | |||
**Pacjenci z segmentem Barretta < 3 cm i z metaplazją jelitową w jego obrębie powinni podlegać nadzorowi onkologicznemu w postaci badania wykonywanego co 3-5 lat | |||
**Pacjenci z segmentem Barretta ≥ 3 cm powinni mieć wykonywane badania co 2-3 lata | |||
*Najlepszym biomarkerem dla oceny ryzyka raka jest obecnie stwierdzenie dysplazji potwierdzonej przez dwóch histopatologów wyspecjalizowanych w ocenie materiału z przewodu pokarmowego | |||
u pacjentów z | *Do czasu pojawienia się wyników randomizowanych badań z grupą kontrolną nie można zalecać jako rutynowej metody nadzoru wykonywania panelowych badań biomarkerów | ||
== Postępowanie w przypadku stwierdzenia dysplazji == | |||
*Ze względu na poważne implikacje rozpoznania dysplazji dla dalszego postępowania, zaleca się by wszystkie przypadki podejrzenia dysplazji były weryfikowane przez drugiego histopatologa specjalizującego się w badaniu przewodu pokarmowego, a jeśli planowane jest leczenie zabiegowe - aby odbyła się konsultacja histopatologiczna w ośrodku onkologicznym<ref>Badanie immunohistochemiczne na obecność jądrowego białka p53 może poprawić powtarzalność diagnostyczną rozpoznań dysplazji w przełyku Barretta i powinno być brane pod uwagę jako uzupełnienie rutynowego badania histopatologicznego.</ref>. | |||
*Ze względu na trudności w dalszym postępowaniu, jakie sprawia rozpoznanie "dysplazji niezdefiniowanej" (indefinite dysplasia), wszystkie takie przypadki także powinny być ocenione przez drugiego wyspecjalizowanego histopatologa, a w opisie badania histopatologicznego powinien być wyjaśniony powód, dla użycia tej kategorii. | |||
[[Plik:Schemat Barr-Dysplazja.png|550px]] | |||
[[Media:Schemat Barr-Dysplazja.pdf|Pobierz jako PDF]] | |||
=== Dysplazja niezdefiniowana === | |||
Postępowanie u pacjentów z rozpoznaniem dysplazji niezdefiniowanej polega na '''optymalizacji leczenia przeciwrefluksowego i powtórzeniu badania po 6 miesiącach'''. Jeśli badanie pobranych ponownie wycinków nie wykaże niezdefiniowanej dysplazji - dalszy nadzór | |||
jak u pacjentów bez dysplazji | |||
=== Dysplazja małego stopnia === | |||
Zalecenia dotyczące postępowania w przypadku stwierdzenia dysplazji małego stopnia (''low-grade dysplasia'', LGD) nie są jasne ze względu na skąpą ilość danych dotyczących naturalnego przebiegu tej patologii. Zasadnicze znaczenie ma, by rozpoznanie zostało potwierdzone przez dwóch histopatologów. '''Pacjent powinien być badany endoskopowo w odstępach 6-miesięcznych'''. Nie można obecnie rutynowo zalecać leczenia ablacyjnego, aż do czasu napłynięcia nowych wyników badań. | |||
=== Dysplazja dużego stopnia === | |||
* U wszystkich pacjentów z dysplazją dużego stopnia (''high-grade dysplasia'', HGD) powinna być wykonana gastroskopia - przez eksperta i z wykorzystaniem endoskopu o wysokiej rozdzielczości - w celu wykrycia wszelkich widocznych nieprawidłowości kwalifikujących się do resekcji endoskopowej. Nieprawidłowości takie powinny być uważane za zmiany złośliwe do czasu, gdy zostanie potwierdzony inny ich charakter. | |||
*Opis morfologii zmian z wykorzystaniem [[Klasyfikacja Paryska|Klasyfikacji Paryskiej]] daje wskazówki co do prawdopodobieństwa rozwoju inwazyjnego raka i ułatwia komunikację między klinicystami. Powinna być więc ona używana do opisu wszystkich widocznych zmian, ale obecnie nie można jej wykorzystywać do przewidywania rokowania. | |||
*Przypadki wszystkich pacjentów, u których wykryto dysplazję lub wczesnego raka i u których rozważane jest leczenie, powinny zostać omówione w multidyscyplinarnym zespole zajmującym się nowotworami przełyku i żołądka. W skład takiego zespołu wchodzić powinien endoskopista zabiegowy, chirurg-onkolog wyspecjalizowany w zabiegach ba górnym odcinku przewodu pokarmowego, radiologa i histopatologa specjalizującego się w badaniu przewodu pokarmowego (standard minimalny). Pacjenci ci powinni zostać poinformowani o możliwych sposobach leczenia i mieć dostęp do wszystkich potrzebnych specjalistów. | |||
== Leczenie neoplazji związanej z przełykiem Barretta == | |||
[[Plik:Schemat Barr Dysplazja2.png|550px]] | |||
[[Media:Schemat Barr Dysplazja2.pdf|Pobierz jako PDF]] | |||
=== Leczenie endoskopowe === | |||
*Leczenie endoskopowe jest preferowanym postępowaniem w przypadku HGD oraz gruczolakoraka ograniczonego do błony śluzowej<ref>Leczenie endoskopowe przełyku Barretta powinno być prowadzone w referencyjnych ośrodkach mogących zaproponować pacjentom obydwie opcje leczenia: zarówno endoskopową, jak i chirurgiczną. W celu nabycia biegłości technicznej, poznania algorytmów postępowania oraz umiejętności leczenia powikłań należy przeprowadzić pod nadzorem co najmniej 30 ER oraz 30 zabiegów ablacji endoskopowej zmian.</ref>. | |||
*Ani rola tomografii komputerowej, ani pozytronowej tomografii emisyjnej wykonywanej przed ER w celu stage'ingu pacjentów z HGD lub podejrzewanym gruczolakorakiem T1 nie jest jasna, badania te nie powinny być więc w takich przypadkach rutynowo wykonywane. | |||
*Podobnie, nie można zalecać rutynowego wykonywania EUS w celu stage'ingu, gdyż metoda ta nie jest wystarczająca dokładna w przypadku zmian T1. W wybranych przypadkach, kiedy endoskopista nie może wykluczyć wysokiego stopnia zaawansowania zmiany na podstawie endoskopowego wyglądu zmian węzłowych, można wykonać EUS z biopsją cienkoigłową (''fine needle aspiration'', FNA) lub bez. Również w wybranych przypadkach gruczolakoraków T1b (sm1), które kwalifikowane są do leczenia endoskopowego, zalecane jest wykonanie EUS, z FNA lub bez biopsji widocznych węzłów chlonnych, ze względu na znaczne ryzyko zajęcia węzłów przez proces nowotworowy. | |||
*Resekcja endoskopowa (''endoscopic resection'', ER) widocznych zmian związanych z neoplazją w przełyku Barretta | |||
**Celem ER jest usunięcie wszystkich widocznych nieprawidłowości | |||
**Zabieg ten jest rekomendowany jako najdokładniejsza metoda oceny zaawansowania wczesnej neoplazji w przełyku Barretta | |||
**ER powinna być uważana za metodę z wyboru w przypadku dysplazji związanej z widocznymi zmianami oraz gruczolakoraka o zaawansowaniu T1a | |||
**W przypadku pacjentów obciążonych dużym ryzykiem operacyjnym, ER może być oferowana jako alternatywa dla zabiegu chirurgicznego w leczeniu dobrze rokujących gruczolakoraków T1b (T1b sm1, dobrze zróżnicowane i bez zajęcia naczyń chłonnych) | |||
**Dla gruczolakoraków T1b z zajęciem drugiej lub kolejnych warstw podśluzówki (T1b sm2-sm3) ER nie może być traktowana jako metoda prowadząca do wyleczenia | |||
**Za równie skuteczne metody ER uważane są technika z wykorzystaniem przezroczystej nakładki, pętli diatermicznej i iniekcją podśluzówkową oraz technika z wykorzystaniem opaski gumowej bez iniekcji podśluzówkowej | |||
*Leczenie ablacyjne płaskich ognisk HGD oraz pozostałości przełyku Barretta po wcześniejszym zabiegu ER | |||
**Przypadki HGD lub raka śródśluzówkowego bez widocznych zmian (płaska HGD/płaski rak śródśluzówkowy) powinny być leczone techniką ablacji endoskopowej. | |||
**Istnieje niewiele danych z badań porównawczych, jednak obecnie uważa się, że w porównaniu z innymi metodami ablacja prądem o częstotliwości radiowej (''Radio-Frequency Ablation'', RFA) jest bezpieczniejsza, ma mniej działań niepożądanych i jest równie skuteczna | |||
**Likwidacja resztek przełyku Barretta pozostałych po miejscowej ER zmniejsza ryzyko późniejszego nowotworzenia i jest zalecana. | |||
**Po endoskopowym leczeniu neoplazji w obrębie przełyku Barretta zalecany jest nadzór onkologiczny z pobieraniem wycinków z GOJ oraz z obszaru wcześniejszego zasięgu przełyku Barretta. | |||
*Po leczeniu endoskopowym badanie kontrolne powinno być wykonane w ciągu 3-12 miesięcy, a następnie w odstępach rocznych. Wycinki należy pobierać z GOJ oraz z okolicy, gdzie uprzednio znajdował się segment Barretta. | |||
=== Leczenie chirurgiczne wczesnej neoplazji w przełyku Barretta === | |||
*Leczenie chirurgiczne uważane jest za metodę z wyboru w przypadku wczesnego gruczolakoraka, który nacieka błonę podśluzową ze względu na istotne ryzyko przerzutowania do węzłów chłonnych | |||
*Ezofagektomia powinna być wykonywana w ośrodkach wykonujących wiele takich zabiegów, gdyż zmniejsza to ryzyko śmiertelności szpitalnej w stosunku do ośrodków z niewielką liczbą wykonywanych zabiegów | |||
*Brak jest obecnie danych, by wyróżniać jakąś technikę ezofagektomii względem innych. Zaleca się dobór metody do poszczególnego przypadku z uwzględnieniem doświadczenia wykonującego zabieg ośrodka | |||
*Brak jest obecnie danych, by zalecać nadzór endoskopowy po ezofagektomii wykonanej z powodu HGD lub gruczolakoraka T1 pod warunkiem, że podczas operacji usunięto całość śluzówki Barretta. Do czasu uzyskania dalszych danych, należy zalecać wykonywanie badań | |||
endoskopowych jedynie w przypadkach uzasadnionych objawami pacjenta | |||
{| class="wikitable" | |||
się | |||
{| | |||
! height="30px" style="background-color: #efefef;" | Klasa | ! height="30px" style="background-color: #efefef;" | Klasa | ||
! height="30px" style="background-color: #efefef;" | Opis | ! height="30px" style="background-color: #efefef;" | Opis | ||
| Linia 178: | Linia 115: | ||
|- | |- | ||
| height="20px" | <div style="margin-left: 20px;">sm3<br /></div> | | height="20px" | <div style="margin-left: 20px;">sm3<br /></div> | ||
| <div style="margin-left: 10px;">Naciek dolnej 1/3<br /></div | | <div style="margin-left: 10px;">Naciek dolnej 1/3<br /></div> | ||
|} | |} | ||
=== Kwestie ekonomiczne === | |||
*Brak jest wystarczających dowodów wskazujących na efektywność kosztową badań przesiewowych i nadzoru onkologicznego w przełyku Barretta. Oczekuje się na wyniki dalszych badań nad nie-endoskopowymi metodami diagnostycznymi. | |||
*Leczenie endoskopowe dysplazji i wczesnego gruczolakoraka w obrębie przełyku Barretta jest efektywne kosztowo w porównaniu z ezofagektomią | |||
== Strategie chemoprewencji i leczenia objawów == | |||
*Brak jest wystarczających dowodów, by zalecać leki hamujące wydzielanie kwasu solnego, jako chemoprewencji raka | |||
*Używanie leków hamujących wydzielanie kwasu solnego jest zalecane w celu usuwania objawów choroby | |||
*Najlepszy profil kliniczny dla leczenia objawowego mają inhibitory pompy protonowej (''proton pump inhibitors'', PPI) | |||
*Zabiegi antyrefluksowe nie mają wyższości nad farmakologicznym hamowaniem wydzielania kwasu solnego w zapobieganiu rozwojowi neoplazji w przełyku Barretta | |||
*Zabieg antyrefluksowy powinien być rozważany u pacjentów ze słabą bądź niepełną kontrolą objawów przez leki hamujące wydzielanie kwasu solnego | |||
*Brak jest obecnie wystarczających dowodów by zalecać stosowanie kwasu acetylosalicylowego, niesteroidowych leków przeciwzapalnych lub innej chemoprewencji u pacjentów z przełykiem Barretta | |||
== Obszar dalszych badań == | |||
Poniżej wymieniono udoskonalenia, które zrewolucjonizowałyby opiekę nad pacjentami z przełykiem Barretta, badania nad nimi powinny więc stanowić priorytet przy planowaniu polityki zdrowotnej i finansowaniu. | |||
*Nie-endoskopowe metody rozpoznawania i nadzoru przełyku Barretta | |||
*Wyjaśnienie, czy prowadzenie nadzoru rzeczywiście wpływa na obniżenie umieralności | |||
Brak jest wystarczających dowodów wskazujących na efektywność | *Wyjaśnienie wpływu badań przesiewowych i nadzoru na jakość życia | ||
kosztową badań przesiewowych i nadzoru onkologicznego w przełyku | *Wykorzystanie zaawansowanych technik obrazowania dla zwiększenia wykrywalności dysplazji i poprawy efektywności kosztowej nadzoru | ||
Barretta. Oczekuje się na wyniki dalszych badań nad | *Znalezienie lepszych biomarkerów poziomów ryzyka. co pozwoliłoby polepszyć lub zastąpić histopatologiczną ocenę dysplazji oraz lepiej ustalać wskazania do ablacji endoskopowej | ||
nie-endoskopowymi metodami diagnostycznymi. | *Dalsze badanie naturalnej historii przełyku Barretta, zwłaszcza przypadków bardzo krótkich segmentów Barretta, dysplazji małego stopnia oraz konkretnych profili molekularnych | ||
Leczenie endoskopowe dysplazji i wczesnego gruczolakoraka w obrębie | *Znalezienie dowodów na to, że leczenie endoskopowe daje trwały efekt i nie pociąga za sobą konieczności prowadzenia długotrwałego nadzoru endoskopowego lub, że nadzór taki może być zastąpiony technikami nie-endoskopowymi bardziej efektywnymi kosztowo | ||
przełyku Barretta jest efektywne kosztowo w porównaniu z | *Określenie roli chemoprewencji | ||
Brak jest wystarczających dowodów, by zalecać leki hamujące | == Przypisy == | ||
wydzielanie kwasu solnego, jako chemoprewencji raka | <references /> | ||
Używanie leków hamujących wydzielanie kwasu solnego jest zalecane w | |||
celu usuwania objawów choroby | == Bibliografia == | ||
Najlepszy profil kliniczny dla leczenia objawowego mają inhibitory | Rebecca C Fitzgerald, Massimiliano di Pietro, Krish Ragunath i in. [http://www.bsg.org.uk/images/stories/docs/clinical/guidelines/oesophageal/bsg_barretts_13.pdf ''British Society of Gastroenterology guidelines on the diagnosis and management of Barrett's oesophagus'']. Gut, 2013, 0 s. 1-36. doi:10.1136/gutjnl-2013-305372 | ||
pompy protonowej ( | |||
inhibitors | |||
Zabiegi antyrefluksowe nie mają wyższości nad farmakologicznym | |||
hamowaniem wydzielania kwasu solnego w zapobieganiu rozwojowi | |||
neoplazji w przełyku Barretta | |||
Zabieg antyrefluksowy powinien być rozważany u pacjentów ze słabą | |||
bądź niepełną kontrolą objawów przez leki hamujące wydzielanie kwasu | |||
solnego | |||
Brak jest obecnie wystarczających dowodów by zalecać stosowanie | |||
kwasu acetylosalicylowego, niesteroidowych leków przeciwzapalnych | |||
lub innej chemoprewencji u pacjentów z przełykiem Barretta | |||
Poniżej wymieniono udoskonalenia, które zrewolucjonizowałyby opiekę nad | |||
pacjentami z przełykiem Barretta, badania nad nimi powinny więc stanowić | |||
priorytet przy planowaniu polityki zdrowotnej i finansowaniu. | |||
Nie-endoskopowe metody rozpoznawania i nadzoru przełyku Barretta | |||
Wyjaśnienie, czy prowadzenie nadzoru rzeczywiście wpływa na | |||
obniżenie umieralności | |||
Wyjaśnienie wpływu badań przesiewowych i nadzoru na jakość życia | |||
Wykorzystanie zaawansowanych technik obrazowania dla zwiększenia | |||
wykrywalności dysplazji i poprawy efektywności kosztowej | |||
Znalezienie lepszych biomarkerów poziomów ryzyka. co pozwoliłoby | |||
polepszyć lub zastąpić histopatologiczną ocenę dysplazji oraz lepiej | |||
ustalać wskazania do ablacji endoskopowej | |||
Dalsze badanie naturalnej historii przełyku Barretta, zwłaszcza | |||
przypadków bardzo krótkich segmentów Barretta, dysplazji małego | |||
stopnia oraz konkretnych profili molekularnych | |||
Znalezienie dowodów na to, że leczenie endoskopowe daje trwały | |||
efekt i nie pociąga za sobą konieczności prowadzenia długotrwałego | |||
nadzoru endoskopowego lub, że nadzór taki może być zastąpiony | |||
technikami nie-endoskopowymi bardziej efektywnymi kosztowo | |||
Określenie roli chemoprewencji | |||
Rebecca C Fitzgerald, Massimiliano di Pietro, Krish Ragunath i in. | |||
Society of Gastroenterology guidelines on the diagnosis and | |||
management of Barrett's oesophagus | |||
doi:10.1136/gutjnl-2013-305372 | |||
{{ | {{DEFAULTSORT:Barretta, przełyk}} | ||
[[Kategoria:Choroby]] | [[Kategoria:Choroby]] | ||
[[Kategoria:Choroby przełyku]] | [[Kategoria:Choroby przełyku]] | ||
[[Kategoria:Standardy, wytyczne i zasady postępowania]] | [[Kategoria:Standardy, wytyczne i zasady postępowania]] | ||
[[Kategoria:British Society of Gastroenterology]] | [[Kategoria:British Society of Gastroenterology]] | ||
[[Kategoria:Wszystkie artykuły]] | |||
Aktualna wersja na dzień 14:20, 1 sie 2015
Diagnostyka i postępowanie w przełyku Barretta - wytyczne British Society of Gastroenterology (2013)
Rozpoznanie
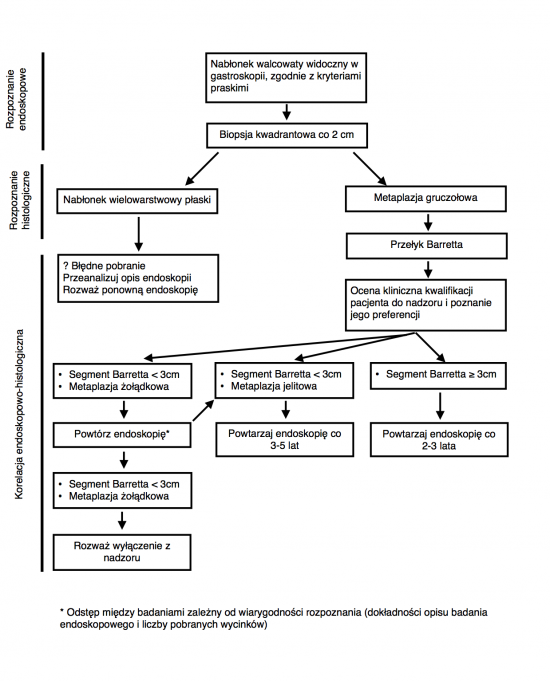
- Przełykiem Barretta określą się stan, w którym jakakolwiek część prawidłowego płaskiego nabłonka dalszej części przełyku zostaje zastąpiona przez metaplastyczny nabłonek walcowaty[1] dobrze widoczny w badaniu endoskopowym (≥ 1 cm) ponad łączem przełykowo-żołądkowym (Gastro-Oesophageal Junction, GOJ)[2] i potwierdzony badaniem histopatologicznym pobranych podczas gastroskopii wycinków[3].
- Opis badania endoskopowego powinien zawierać co najmniej:
- długość segmentu Barretta (według kryteriów praskich: C - zasięg zmian zajmujących cały obwód, M - maksymalny zasięg zmian wyrażony w centymetrach)
- opis wszystkich wysp nabłonka walcowatego dostrzeżonych ponad górną granicą zasięgu zmian ciągłych
Badania przesiewowe w kierunku przełyku Barretta
- Prowadzenie w populacji ogólnej badań przesiewowych w kierunku przełyku Barretta z wykorzystaniem gastroskopii nie jest możliwe ani uzasadnione.
- Prowadzenie takich badań może zostać rozważone w przypadku pacjentów z przewlekłymi objawami choroby refluksowej przełyku (gastro-oesophageal reflux disease, GERD) i z co najmniej trzema czynnikami ryzyka tego stanu[4]. Warunek obecności trzech czynników ryzyka nie obowiązuje w przypadku osób z wywiadami rodzinnymi przełyku Barretta lub gruczolakoraka przełyku u krewnego I stopnia.
Nadzór onkologiczny pacjentów z przełykiem Barretta
- Pomimo braku dostatecznej ilości danych z badań randomizowanych, wskazujących na to, że prowadzenie nadzoru koreluje z niższym zaawansowaniem wykrywanych zmian i poprawą przeżywalnością, nadzór onkologiczny jest w zasadzie zalecany.
- Jedyną dostępną obecnie metodą nadzoru, mającą wystarczające oparcie w wynikach badań, jest powtarzanie gastroskopii z poszukiwaniem dysplazji w badaniu histopatologicznym pobranych wycinków
- badania w ramach nadzoru powinny być wykonywane endoskopami o wysokiej rozdzielczości
- brak wystarczającej ilości danych, by zalecać wykonywanie w ramach nadzoru gastroskopii przeznosowej w miejsce klasycznej
- zaawansowane techniki obrazowania, takie jak chromoendoskopia czy "wirtualna chromoendoskopia" nie mają w nadzorze przełyku Barretta przewagi nad gastroskopią z użyciem światła białego i nie powinny być dlatego zalecane do rutynowego stosowania
- nadzór onkologiczny nie jest generalnie zalecany u pacjentów z MJ wpustu oraz z nieregularnym przebiegiem linii Z, niezależnie od tego czy stwierdzono u nich MJ czy nie
- wycinki powinny być pobierane z 4 kwadrantów co 2 cm oraz ze wszystkich widocznych zmian
- Programy nadzoru onkologicznego powinny brać pod uwagę obecność MJ oraz długość segmentu Barretta[5]
- Pacjenci z segmentem Barretta < 3 cm, u których badanie histopatologiczne nie wykazało MJ ani dysplazji - zalecana jest powtórna gastroskopia z biopsją kwadrantową dla potwierdzenia rozpoznania po 3-5 latach (czas ten może być krótszy, jeśli rozpoznanie jest mało wiarygodne). Jeśli ponowne badanie potwierdzi brak MJ zaleca się wyłączenie pacjenta z nadzoru, gdyż ryzyko związane z badaniem przewyższa prawdopodobnie wynikające z niego korzyści
- Pacjenci z segmentem Barretta < 3 cm i z metaplazją jelitową w jego obrębie powinni podlegać nadzorowi onkologicznemu w postaci badania wykonywanego co 3-5 lat
- Pacjenci z segmentem Barretta ≥ 3 cm powinni mieć wykonywane badania co 2-3 lata
- Najlepszym biomarkerem dla oceny ryzyka raka jest obecnie stwierdzenie dysplazji potwierdzonej przez dwóch histopatologów wyspecjalizowanych w ocenie materiału z przewodu pokarmowego
- Do czasu pojawienia się wyników randomizowanych badań z grupą kontrolną nie można zalecać jako rutynowej metody nadzoru wykonywania panelowych badań biomarkerów
Postępowanie w przypadku stwierdzenia dysplazji
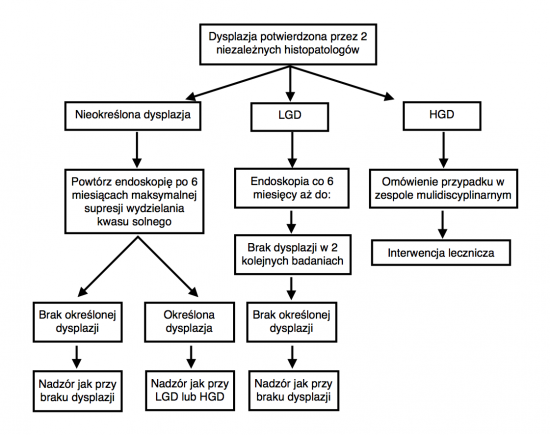
- Ze względu na poważne implikacje rozpoznania dysplazji dla dalszego postępowania, zaleca się by wszystkie przypadki podejrzenia dysplazji były weryfikowane przez drugiego histopatologa specjalizującego się w badaniu przewodu pokarmowego, a jeśli planowane jest leczenie zabiegowe - aby odbyła się konsultacja histopatologiczna w ośrodku onkologicznym[6].
- Ze względu na trudności w dalszym postępowaniu, jakie sprawia rozpoznanie "dysplazji niezdefiniowanej" (indefinite dysplasia), wszystkie takie przypadki także powinny być ocenione przez drugiego wyspecjalizowanego histopatologa, a w opisie badania histopatologicznego powinien być wyjaśniony powód, dla użycia tej kategorii.
Dysplazja niezdefiniowana
Postępowanie u pacjentów z rozpoznaniem dysplazji niezdefiniowanej polega na optymalizacji leczenia przeciwrefluksowego i powtórzeniu badania po 6 miesiącach. Jeśli badanie pobranych ponownie wycinków nie wykaże niezdefiniowanej dysplazji - dalszy nadzór jak u pacjentów bez dysplazji
Dysplazja małego stopnia
Zalecenia dotyczące postępowania w przypadku stwierdzenia dysplazji małego stopnia (low-grade dysplasia, LGD) nie są jasne ze względu na skąpą ilość danych dotyczących naturalnego przebiegu tej patologii. Zasadnicze znaczenie ma, by rozpoznanie zostało potwierdzone przez dwóch histopatologów. Pacjent powinien być badany endoskopowo w odstępach 6-miesięcznych. Nie można obecnie rutynowo zalecać leczenia ablacyjnego, aż do czasu napłynięcia nowych wyników badań.
Dysplazja dużego stopnia
- U wszystkich pacjentów z dysplazją dużego stopnia (high-grade dysplasia, HGD) powinna być wykonana gastroskopia - przez eksperta i z wykorzystaniem endoskopu o wysokiej rozdzielczości - w celu wykrycia wszelkich widocznych nieprawidłowości kwalifikujących się do resekcji endoskopowej. Nieprawidłowości takie powinny być uważane za zmiany złośliwe do czasu, gdy zostanie potwierdzony inny ich charakter.
- Opis morfologii zmian z wykorzystaniem Klasyfikacji Paryskiej daje wskazówki co do prawdopodobieństwa rozwoju inwazyjnego raka i ułatwia komunikację między klinicystami. Powinna być więc ona używana do opisu wszystkich widocznych zmian, ale obecnie nie można jej wykorzystywać do przewidywania rokowania.
- Przypadki wszystkich pacjentów, u których wykryto dysplazję lub wczesnego raka i u których rozważane jest leczenie, powinny zostać omówione w multidyscyplinarnym zespole zajmującym się nowotworami przełyku i żołądka. W skład takiego zespołu wchodzić powinien endoskopista zabiegowy, chirurg-onkolog wyspecjalizowany w zabiegach ba górnym odcinku przewodu pokarmowego, radiologa i histopatologa specjalizującego się w badaniu przewodu pokarmowego (standard minimalny). Pacjenci ci powinni zostać poinformowani o możliwych sposobach leczenia i mieć dostęp do wszystkich potrzebnych specjalistów.
Leczenie neoplazji związanej z przełykiem Barretta
Leczenie endoskopowe
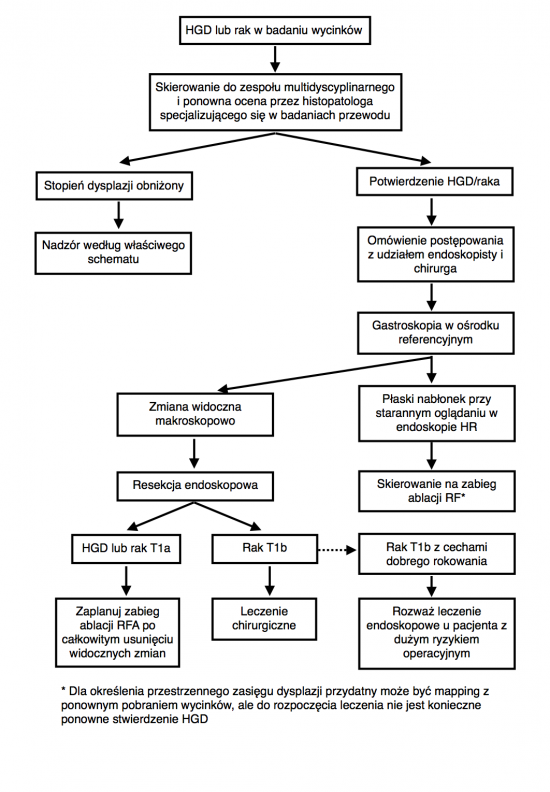
- Leczenie endoskopowe jest preferowanym postępowaniem w przypadku HGD oraz gruczolakoraka ograniczonego do błony śluzowej[7].
- Ani rola tomografii komputerowej, ani pozytronowej tomografii emisyjnej wykonywanej przed ER w celu stage'ingu pacjentów z HGD lub podejrzewanym gruczolakorakiem T1 nie jest jasna, badania te nie powinny być więc w takich przypadkach rutynowo wykonywane.
- Podobnie, nie można zalecać rutynowego wykonywania EUS w celu stage'ingu, gdyż metoda ta nie jest wystarczająca dokładna w przypadku zmian T1. W wybranych przypadkach, kiedy endoskopista nie może wykluczyć wysokiego stopnia zaawansowania zmiany na podstawie endoskopowego wyglądu zmian węzłowych, można wykonać EUS z biopsją cienkoigłową (fine needle aspiration, FNA) lub bez. Również w wybranych przypadkach gruczolakoraków T1b (sm1), które kwalifikowane są do leczenia endoskopowego, zalecane jest wykonanie EUS, z FNA lub bez biopsji widocznych węzłów chlonnych, ze względu na znaczne ryzyko zajęcia węzłów przez proces nowotworowy.
- Resekcja endoskopowa (endoscopic resection, ER) widocznych zmian związanych z neoplazją w przełyku Barretta
- Celem ER jest usunięcie wszystkich widocznych nieprawidłowości
- Zabieg ten jest rekomendowany jako najdokładniejsza metoda oceny zaawansowania wczesnej neoplazji w przełyku Barretta
- ER powinna być uważana za metodę z wyboru w przypadku dysplazji związanej z widocznymi zmianami oraz gruczolakoraka o zaawansowaniu T1a
- W przypadku pacjentów obciążonych dużym ryzykiem operacyjnym, ER może być oferowana jako alternatywa dla zabiegu chirurgicznego w leczeniu dobrze rokujących gruczolakoraków T1b (T1b sm1, dobrze zróżnicowane i bez zajęcia naczyń chłonnych)
- Dla gruczolakoraków T1b z zajęciem drugiej lub kolejnych warstw podśluzówki (T1b sm2-sm3) ER nie może być traktowana jako metoda prowadząca do wyleczenia
- Za równie skuteczne metody ER uważane są technika z wykorzystaniem przezroczystej nakładki, pętli diatermicznej i iniekcją podśluzówkową oraz technika z wykorzystaniem opaski gumowej bez iniekcji podśluzówkowej
- Leczenie ablacyjne płaskich ognisk HGD oraz pozostałości przełyku Barretta po wcześniejszym zabiegu ER
- Przypadki HGD lub raka śródśluzówkowego bez widocznych zmian (płaska HGD/płaski rak śródśluzówkowy) powinny być leczone techniką ablacji endoskopowej.
- Istnieje niewiele danych z badań porównawczych, jednak obecnie uważa się, że w porównaniu z innymi metodami ablacja prądem o częstotliwości radiowej (Radio-Frequency Ablation, RFA) jest bezpieczniejsza, ma mniej działań niepożądanych i jest równie skuteczna
- Likwidacja resztek przełyku Barretta pozostałych po miejscowej ER zmniejsza ryzyko późniejszego nowotworzenia i jest zalecana.
- Po endoskopowym leczeniu neoplazji w obrębie przełyku Barretta zalecany jest nadzór onkologiczny z pobieraniem wycinków z GOJ oraz z obszaru wcześniejszego zasięgu przełyku Barretta.
- Po leczeniu endoskopowym badanie kontrolne powinno być wykonane w ciągu 3-12 miesięcy, a następnie w odstępach rocznych. Wycinki należy pobierać z GOJ oraz z okolicy, gdzie uprzednio znajdował się segment Barretta.
Leczenie chirurgiczne wczesnej neoplazji w przełyku Barretta
- Leczenie chirurgiczne uważane jest za metodę z wyboru w przypadku wczesnego gruczolakoraka, który nacieka błonę podśluzową ze względu na istotne ryzyko przerzutowania do węzłów chłonnych
- Ezofagektomia powinna być wykonywana w ośrodkach wykonujących wiele takich zabiegów, gdyż zmniejsza to ryzyko śmiertelności szpitalnej w stosunku do ośrodków z niewielką liczbą wykonywanych zabiegów
- Brak jest obecnie danych, by wyróżniać jakąś technikę ezofagektomii względem innych. Zaleca się dobór metody do poszczególnego przypadku z uwzględnieniem doświadczenia wykonującego zabieg ośrodka
- Brak jest obecnie danych, by zalecać nadzór endoskopowy po ezofagektomii wykonanej z powodu HGD lub gruczolakoraka T1 pod warunkiem, że podczas operacji usunięto całość śluzówki Barretta. Do czasu uzyskania dalszych danych, należy zalecać wykonywanie badań
endoskopowych jedynie w przypadkach uzasadnionych objawami pacjenta
| Klasa | Opis |
|---|---|
T1a
|
|
m1
|
Rak in
situ lub wątpliwy naciek poza błonę podstawną
|
m2
|
Naciek blaszki właściwej
|
m3
|
Naciek błony mięśniowej
|
T1b
|
|
sm1
|
Naciek górnej 1/3 podśluzówki, nie
więcej niż 500 μm
|
sm2
|
Naciek środkowej 1/3
|
sm3
|
Naciek dolnej 1/3
|
Kwestie ekonomiczne
- Brak jest wystarczających dowodów wskazujących na efektywność kosztową badań przesiewowych i nadzoru onkologicznego w przełyku Barretta. Oczekuje się na wyniki dalszych badań nad nie-endoskopowymi metodami diagnostycznymi.
- Leczenie endoskopowe dysplazji i wczesnego gruczolakoraka w obrębie przełyku Barretta jest efektywne kosztowo w porównaniu z ezofagektomią
Strategie chemoprewencji i leczenia objawów
- Brak jest wystarczających dowodów, by zalecać leki hamujące wydzielanie kwasu solnego, jako chemoprewencji raka
- Używanie leków hamujących wydzielanie kwasu solnego jest zalecane w celu usuwania objawów choroby
- Najlepszy profil kliniczny dla leczenia objawowego mają inhibitory pompy protonowej (proton pump inhibitors, PPI)
- Zabiegi antyrefluksowe nie mają wyższości nad farmakologicznym hamowaniem wydzielania kwasu solnego w zapobieganiu rozwojowi neoplazji w przełyku Barretta
- Zabieg antyrefluksowy powinien być rozważany u pacjentów ze słabą bądź niepełną kontrolą objawów przez leki hamujące wydzielanie kwasu solnego
- Brak jest obecnie wystarczających dowodów by zalecać stosowanie kwasu acetylosalicylowego, niesteroidowych leków przeciwzapalnych lub innej chemoprewencji u pacjentów z przełykiem Barretta
Obszar dalszych badań
Poniżej wymieniono udoskonalenia, które zrewolucjonizowałyby opiekę nad pacjentami z przełykiem Barretta, badania nad nimi powinny więc stanowić priorytet przy planowaniu polityki zdrowotnej i finansowaniu.
- Nie-endoskopowe metody rozpoznawania i nadzoru przełyku Barretta
- Wyjaśnienie, czy prowadzenie nadzoru rzeczywiście wpływa na obniżenie umieralności
- Wyjaśnienie wpływu badań przesiewowych i nadzoru na jakość życia
- Wykorzystanie zaawansowanych technik obrazowania dla zwiększenia wykrywalności dysplazji i poprawy efektywności kosztowej nadzoru
- Znalezienie lepszych biomarkerów poziomów ryzyka. co pozwoliłoby polepszyć lub zastąpić histopatologiczną ocenę dysplazji oraz lepiej ustalać wskazania do ablacji endoskopowej
- Dalsze badanie naturalnej historii przełyku Barretta, zwłaszcza przypadków bardzo krótkich segmentów Barretta, dysplazji małego stopnia oraz konkretnych profili molekularnych
- Znalezienie dowodów na to, że leczenie endoskopowe daje trwały efekt i nie pociąga za sobą konieczności prowadzenia długotrwałego nadzoru endoskopowego lub, że nadzór taki może być zastąpiony technikami nie-endoskopowymi bardziej efektywnymi kosztowo
- Określenie roli chemoprewencji
Przypisy
- ↑ W wytycznych brytyjskich do rozpoznania przełyku Barretta wystarczy stwierdzenie jakiejkowiek metaplazji, a nie tylko metaplazji jelitowej (MJ). Wynika to z faktu, że niektóre badania wykazywały, iż częstość raka u osób bez metaplazji jelitowej i z MJ jest bardzo podobna. Oprócz tego, w długich (>3 cm) segmentach Barretta metaplazja jest prawie zawsze obecna, a jej brak w badaniu histopatologicznym wynika z nietrafionego pobrania wycinków. Jednak obecność MJ powinna być brana pod uwagę przy podejmowaniu decyzji o prowadzeniu nadzoru u pacjenta.
- ↑ Za granicę przełyku i żołądka (GOJ) najłatwiej przyjąć bliższe zakończenia podłużnych fałdów trzonu żołądka przy minimalnej insuflacji. Można też za nią uznać poziom dystalnych zakończeń naczyń palisadowych, ale to kryterium cechuje się znacznie mniejszą powtarzalnością. Obecność wypustek nabłonka walcowatego sięgających mniej niż 1 cm ponad GOJ określa się, jako nieregularną linię Z, a nie jako przełyk Barretta. Do 40% przypadków nieregularnej linii Z może wiązać się z obecnością metaplazji jelitowej, ale znacznie kliniczne tego faktu nie jest jasne. Rutynowe wykonywanie biopsji w przypadku nieregularnej linii Z nie jest konieczne - wykonuje się ją tylko w razie wątpliwości diagnostycznych.
- ↑ Minimalna liczba wycinków, jakie powinny zostać pobrane przy podejrzeniu przełyku Barretta, to 8 (także w przypadku krótkiego segmentu).
- ↑ Czynniki te to:
- wiek ≥ 50
- rasa biała
- płeć męska
- otyłość
- obecność objawów choroby refuksowej
- wywiady rodzinne przełyku Barretta bądź gruczolakoraka przełyku
- palenie tytoniu (tylko w niektórych badaniach)
- ↑ O tym czy w przypadku konkretnego pacjenta należy wdrożyć nadzór decydować powinno prawdopodobieństwo rozwoju u niego raka, jego zdolność do poddania się powtarzanym badaniom, a także jego preferencje.
- ↑ Badanie immunohistochemiczne na obecność jądrowego białka p53 może poprawić powtarzalność diagnostyczną rozpoznań dysplazji w przełyku Barretta i powinno być brane pod uwagę jako uzupełnienie rutynowego badania histopatologicznego.
- ↑ Leczenie endoskopowe przełyku Barretta powinno być prowadzone w referencyjnych ośrodkach mogących zaproponować pacjentom obydwie opcje leczenia: zarówno endoskopową, jak i chirurgiczną. W celu nabycia biegłości technicznej, poznania algorytmów postępowania oraz umiejętności leczenia powikłań należy przeprowadzić pod nadzorem co najmniej 30 ER oraz 30 zabiegów ablacji endoskopowej zmian.
Bibliografia
Rebecca C Fitzgerald, Massimiliano di Pietro, Krish Ragunath i in. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett's oesophagus. Gut, 2013, 0 s. 1-36. doi:10.1136/gutjnl-2013-305372